原子结构与原子键
定义(基本概念)
原子组成:原子是由原子核(质子&中子)及核外电子构成,其中电子带负电,质子带正电,中子()不带电.每种化学元素都由原子核中的质子数()决定.
同位素 :一个原子的原子质量()可由质子数和中子数之和来表示,有些原子的质子数相同但中子数不一样,称这个元素的不同原子为同位素.
原子量 :这个元素的各个同位素的原子质量平均值(各个同位素的占比不同→原子量).
原子质量单位(amu):用的十二分之一来定义1原子质量, (略大)
摩尔:定义一摩尔物质中有(阿伏伽德罗常数) 个原子/分子.
原子序数(Z)=核外电子数=质子数
玻尔原子模型:略
波动力学模型 : 原子中的电子用四个参数表示(量子数-能量,大小,形状,空间方向):
| 量子数 | 表示符号 |
|---|---|
| 主量子数 | |
| 角量子数 | |
| 磁量子数 | |
| 自旋量子数 |
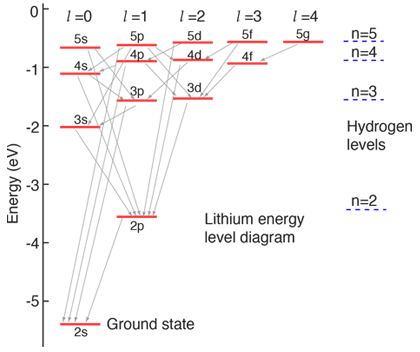
当电子排满低能级时,称其处于基态,原子最外层电子数称为价电子数,它决定了许多元素的物理化学性能.下面是能级图:
电负性
电负性:原子得电子形成负价离子的性质。
电正性:原子失电子形成正价离子的性质。
价电子数越大,越容易失电子,电负性越高,所以元素周期表越右上,元素电负性越大,F电负性最强。
原子键
键合力:根据原子键和原则,原子间作用力分为吸引力🧲和排斥力,其作用力的大小取决于原子间距。
吸引力()源自于两个原子间特殊类型的键,排斥力()来自于原子间负价电子云的相互排斥。两原子间作用力的合力为两者(一正一负)总和:
平衡时距离为,此时合力为0,此时的能量—— 即键能
势能与力的关系如下:
键能与性能之间的关系:
- 键能越大的材料熔点越高。(常温下是固态的物质键能较高,气态的键能较小)
- 弹性模量与原子键有关
主价键
-
离子键:由金属和非金属元素组成的化合物之间的键合力。本质上是库仑力(建议参考大学物理), ,排斥力也类似: 。
离子键
没有方向性,陶瓷材料主要是离子键,硬而脆,具有电绝缘性和热绝缘性 -
共价键:通过相邻原子共用电子而获得稳定的电子组态。原子的共价键数目由价电子数决定
共价键有
方向性,相同非金属元素分子()&不相同非金属元素分子(),聚合物
原子间往往即包含离子键又包含共价键,电负性差异越大,其形成离子键的可能性越大。
-
金属键:经常存在于金属材料当中。金属材料有1,2,3个价电子,价电子在整个金属当中随意游动,形成一个“电子云”
金属键
不具有方向性,所有金属都存在金属键,是良好的电导体和热导体。
次价键(范德华键)
次价键作用力来源于原子或分子的偶极子。分为
- 振动诱导偶极键 (最菜的键)
- 极性分子-诱导偶极键(极性分子之间产生)
- 永久偶极键
- 氢键:极性分子键的特例(最强)